HEMOSTASE COAGULATION RÉACTIFS DE ROUTINE DOSAGES DES FACTEURS DOSAGES COLORIMÉTRIQUES FACTEUR XIII
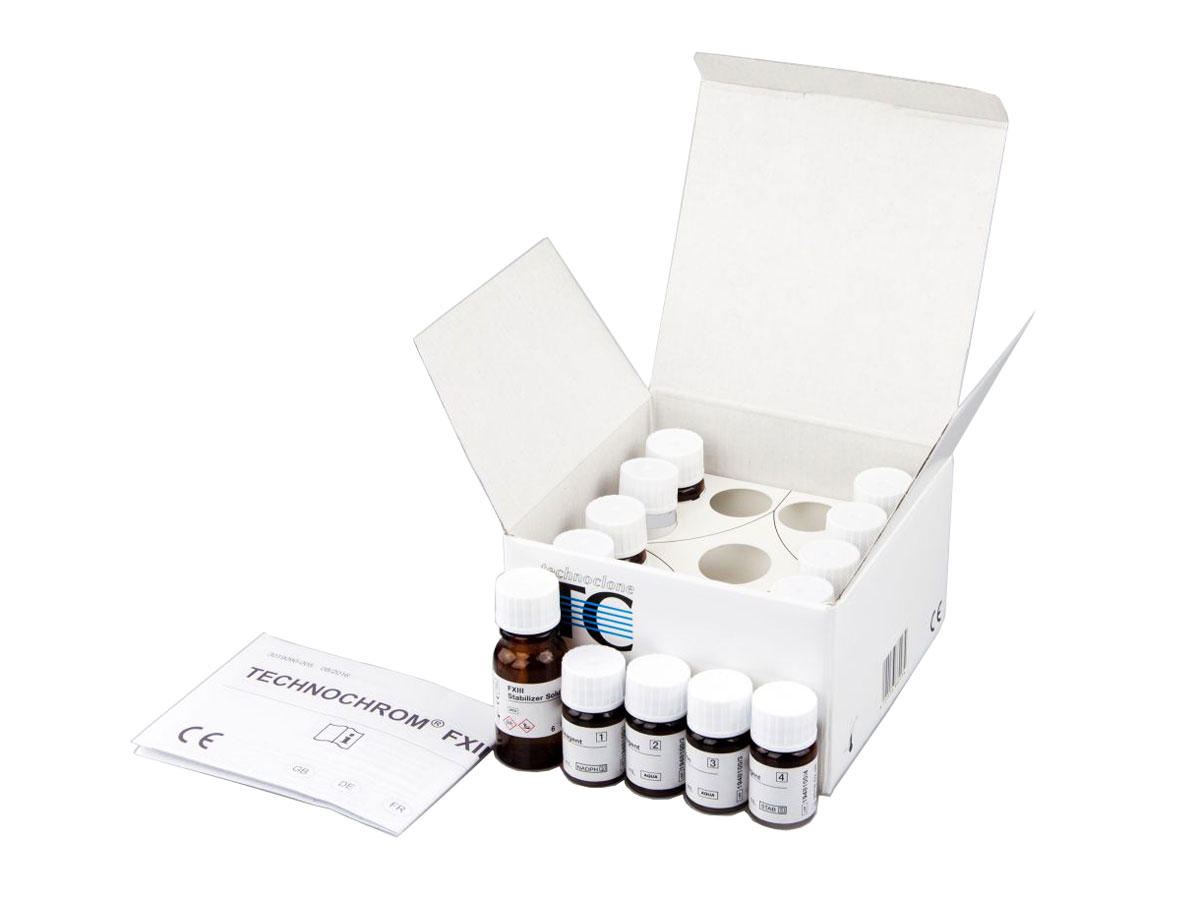
TECHNOCHROM® FXIII
Coffret de dosage pour la détection des déficiences congénitales ou acquises en FXIII, de taux anormal avec une activité faible ou de taux élevé en FXIII.
Le TECHNOCHROM® FXIII est un coffret de dosage enzymatique chromogénique pour la détermination de l’activité du FXIII.
Principe
La détermination de l'activité du FXIII est basée sur la mesure de l'ammoniaque libéré durant la réaction de transglutaminase.
Le FXIII présent dans le plasma est activé en présence de thrombine et de calcium.
La polymérisation de la fibrine est empéchée et donc le FXIIIa va catalyser la transformation d'un substrat aminé d'éthylester de glycine (GEE) en résidu glutamine et libérant un ion ammonium.
La quantité d'ion ammonium libérée est suivie par une réaction dépendante de la NADPH, suivie par le spectrophotomètre avec une diminution de l'absorbance à 340 nm
Informations
Le FXIII ou facteur de stabilisation de la fibrine est le zymogène d'une transglutaminase.
Le FXIII est activé par la thrombine, il intervient dans la phase finale de la fibrinoformation pour stabiliser le caillot de fibrine.
Il intervient également dans les phénomènes de réparation tissulaire et de cicatrisation en permettant l'association du collagène et de la fibronectine.
Il existe des déficits constitutionnels en FXIII qui sont des transmissions autosomiques récessives.
Les formes sévères sont associées à un syndrome hémorragique. La déficience acquise en FXIII due à des autoanticorps anti-FXIII est également une très importante cause de diathèse hémorragique.
La consommation en FXIII dans différentes maladies (infections malignes, maladie de Crohn, purpura Henoch-Schoenlein, chirurgie majeure, …) résulte habituellement d’une baisse modérée du taux de FXIII.
Documentation
Télécharger la fiche produitNotre tarif général, les fiches de sécurité et les notices sont accessibles à nos clients enregistrés.
Dosage colorimétrique







Références
| 4-5360010 | Coffret | 3 x 20 tests |