Substrat fluorogénique ANSN de Facteur Xa
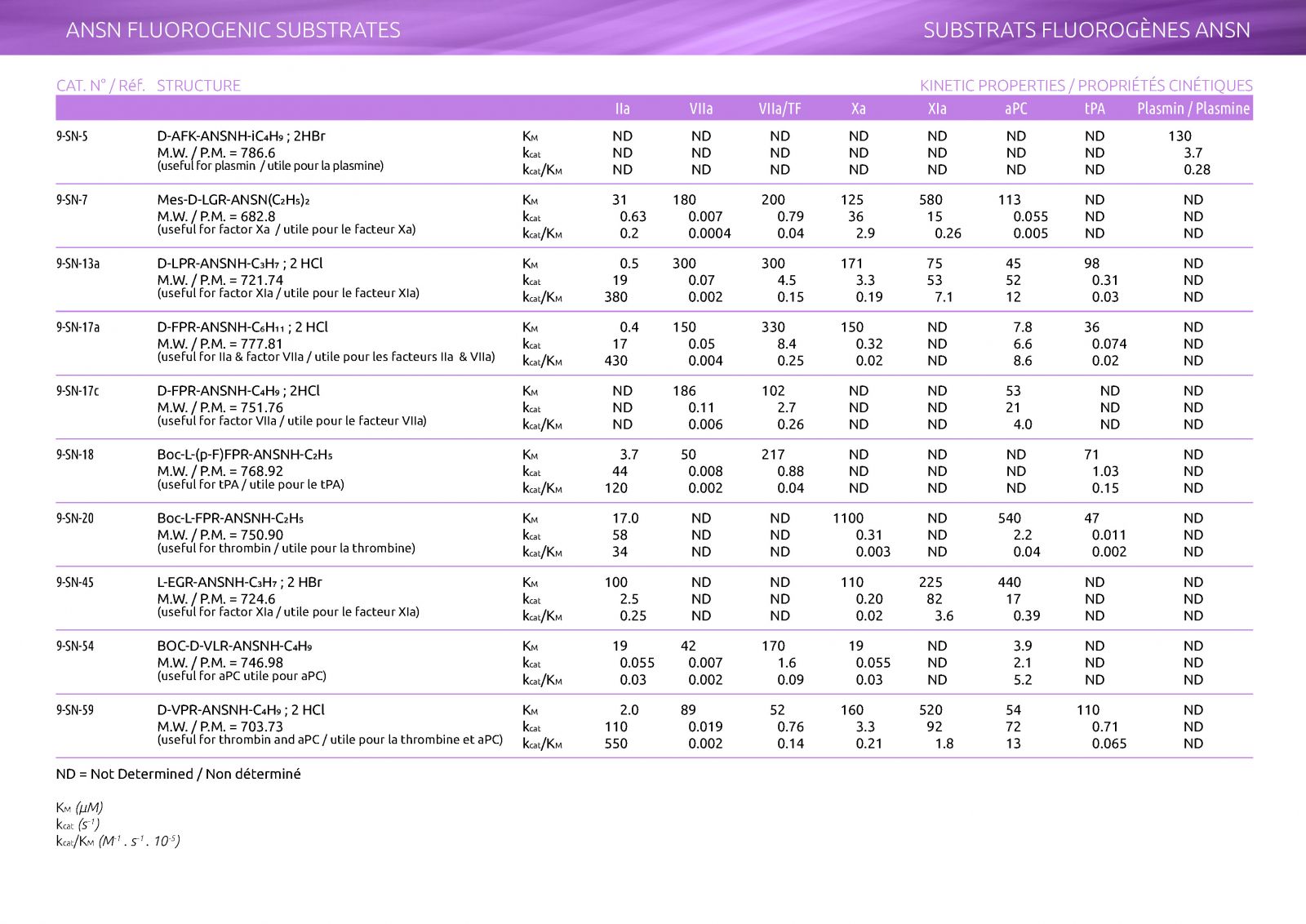
Séquence : Mes-D-LGR-ANSN(C₂H₅), 2HCl
PM(g/mol) : 682,8
Km FIIa : 31 µM - Kcat : 0,63 s-¹
Km FVIIa : 180 µM - Kcat : 0,007 s-¹
Km FVIIa/FT : 200 µM - Kcat : 0,79 s-¹
Km FXa : 125 µM - Kcat : 36 s-¹
Km FXIa : 580 µM - Kcat : 15 s-¹
Km PCa : 113 µM - Kcat : 0,055 s-¹
Informations
Les propriétés cinétiques identifiées aideront à la sélection d’un substrat approprié. Les substrats de ANSN se sont révélés particulièrement utiles pour les analyses du FVIIa. Bien que les vitesses d’hydrolyse du substrat soient relativement lentes pour le FVIIa, seuls quelques composés tels que le composé SN-17 présentent une grande variation de kcat lorsque du Facteur tissulaire est incorporé dans le système de dosage.
Les substrats ANSN sont fournis sous forme de solutions concentrées à 10 mM dans du DMSO. Les dosages sont généralement effectués dans des tampons physiologiques contenant de l’Hépes ou du Tris, avec des concentrations en substrat allant de 1 à 100 µM.
La variation relative de la fluorescence est mesurée à une longueur d’onde d’émission de 470 nm pour une longueur d’onde d’excitation de 352 nm. Les faibles artefacts lumineux peuvent être minimisés en utilisant un filtre de coupure de 390 à 450 nm dans le faisceau d’émission. Les solutions de substrat concentrées en DMSO peuvent être encore solides à 4°C et donc doivent être ramenés à température ambiante avant l'utilisation. Ces substrats doivent être également protégés de la lumière. Dans ces conditions, les composés resteront stables pendant plus d’un an.
Documentation
Télécharger la fiche produitNotre tarif général, les fiches de sécurité et les notices sont accessibles à nos clients enregistrés.


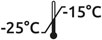


Références
| 9-SN-7 | Flacon | 1 mg |