La cryogénie au service de l'hémostase
Plasma et réactifs congelés
de haute qualité pour
l'hémostase et la coagulation
de haute qualité pour
l'hémostase et la coagulation
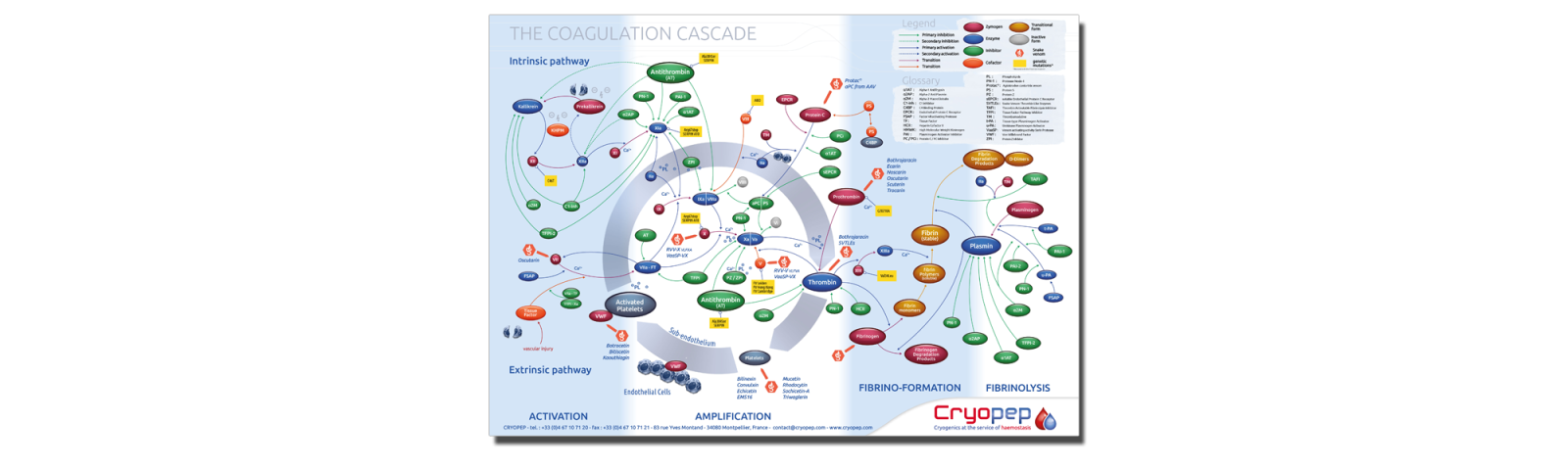
Hémostase et Thrombose: réactifs de routine
pour la coagulation sanguine
pour la coagulation sanguine
Télécharger le catalogue
Voir les réactifs Routine
Hémostase et Thrombose: réactifs de recherche
pour la coagulation sanguine
pour la coagulation sanguine
Télécharger le catalogue
Voir les réactifs Recherche

Substrats chromogènes pour les enzymes
de la cascade de la coagulation
de la cascade de la coagulation
Télécharger le catalogue
Voir les substrats chromogènes

CRYOcheck™ Chromogenic Factor IX
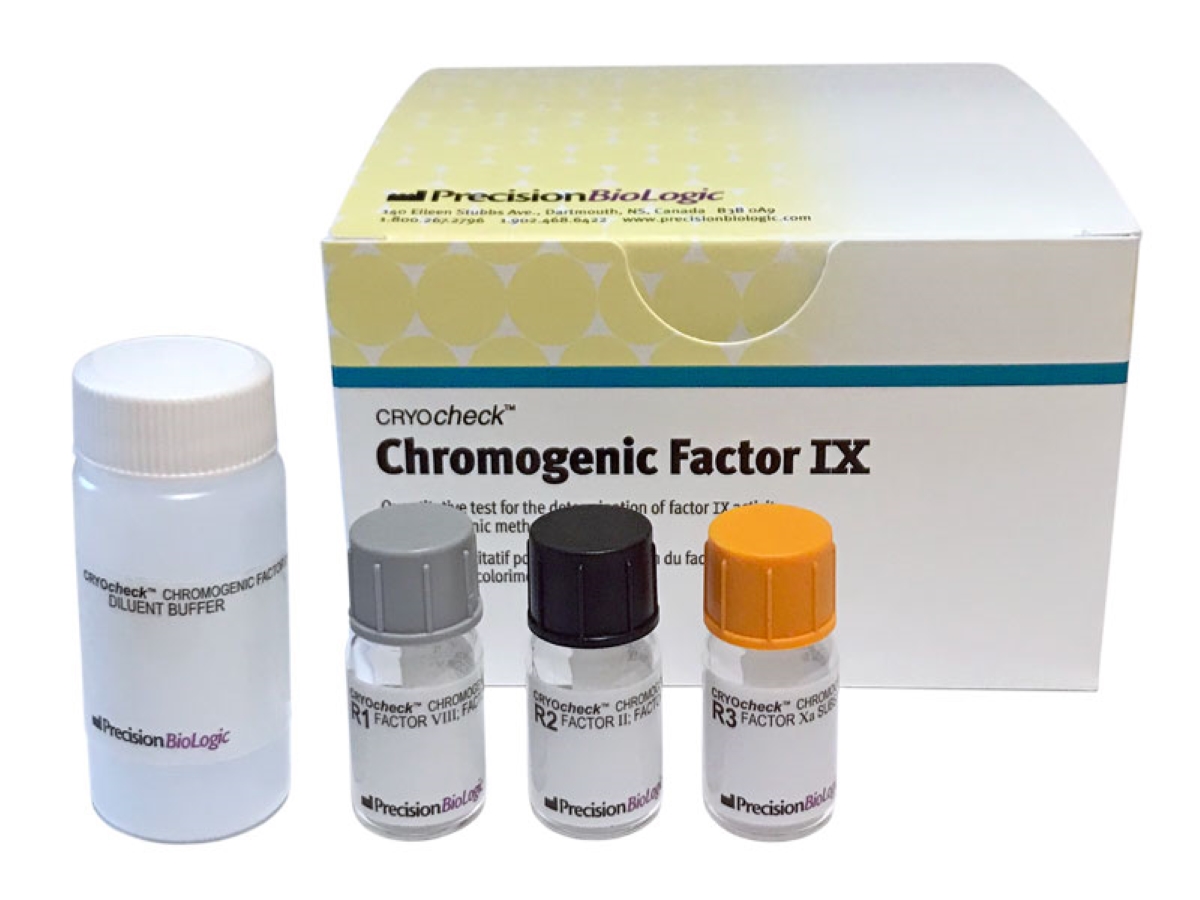
Le CRYOcheck™ Chromogenic Factor IX est un coffret de dosage utilisé pour la détermination quantitative en colorimétrie de l’activité du Facteur IX dans le plasma humain citraté.
CRYOcheck™ Factor VIII Deficient Plasma with VWF
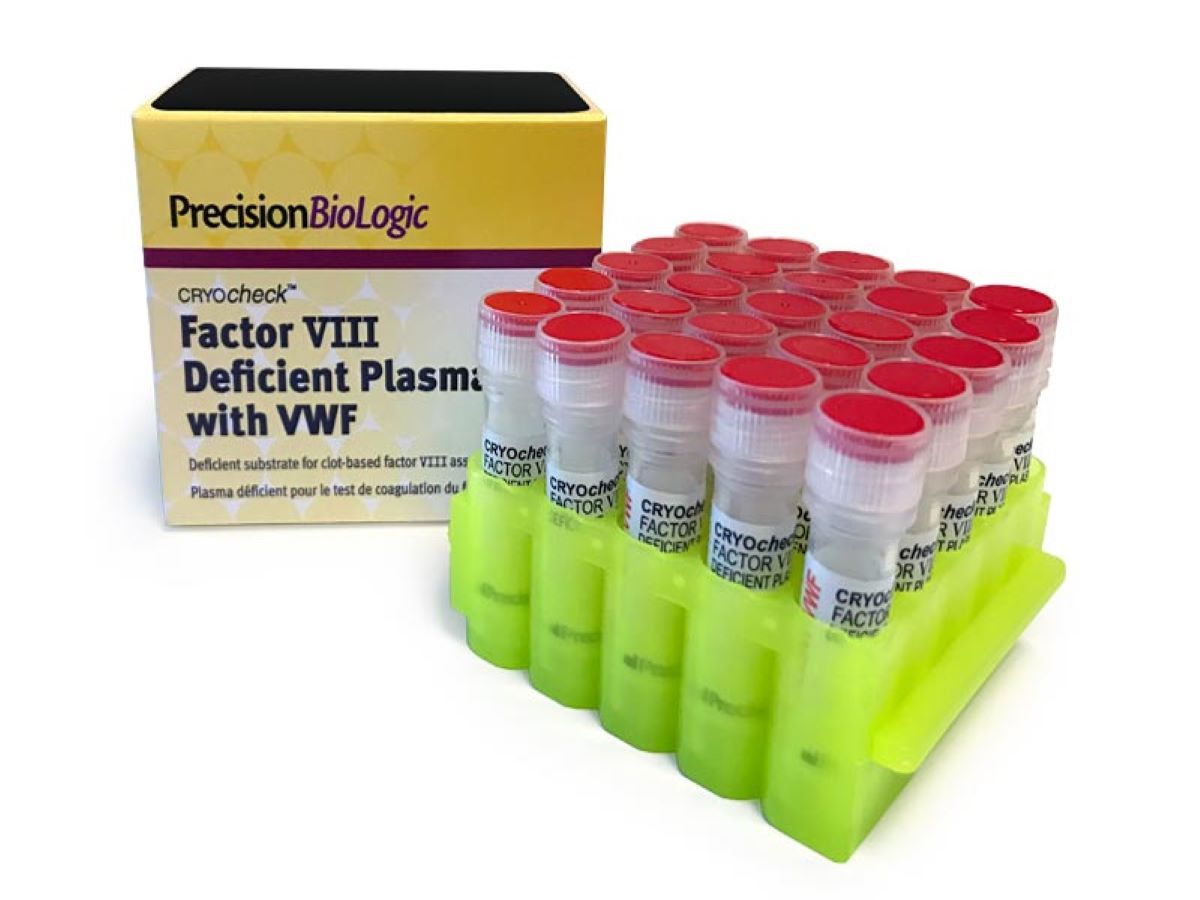
Plasma déficient en Facteur VIII avec un taux normal de facteur von Willebrand (VWF), utilisé pour la recherche d’inhibiteurs du Facteur VIII. Immunodéplété, congelé et pauvre en plaquettes.
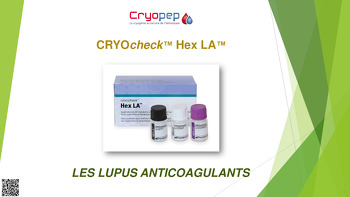
CRYOcheck™ Hex LA™
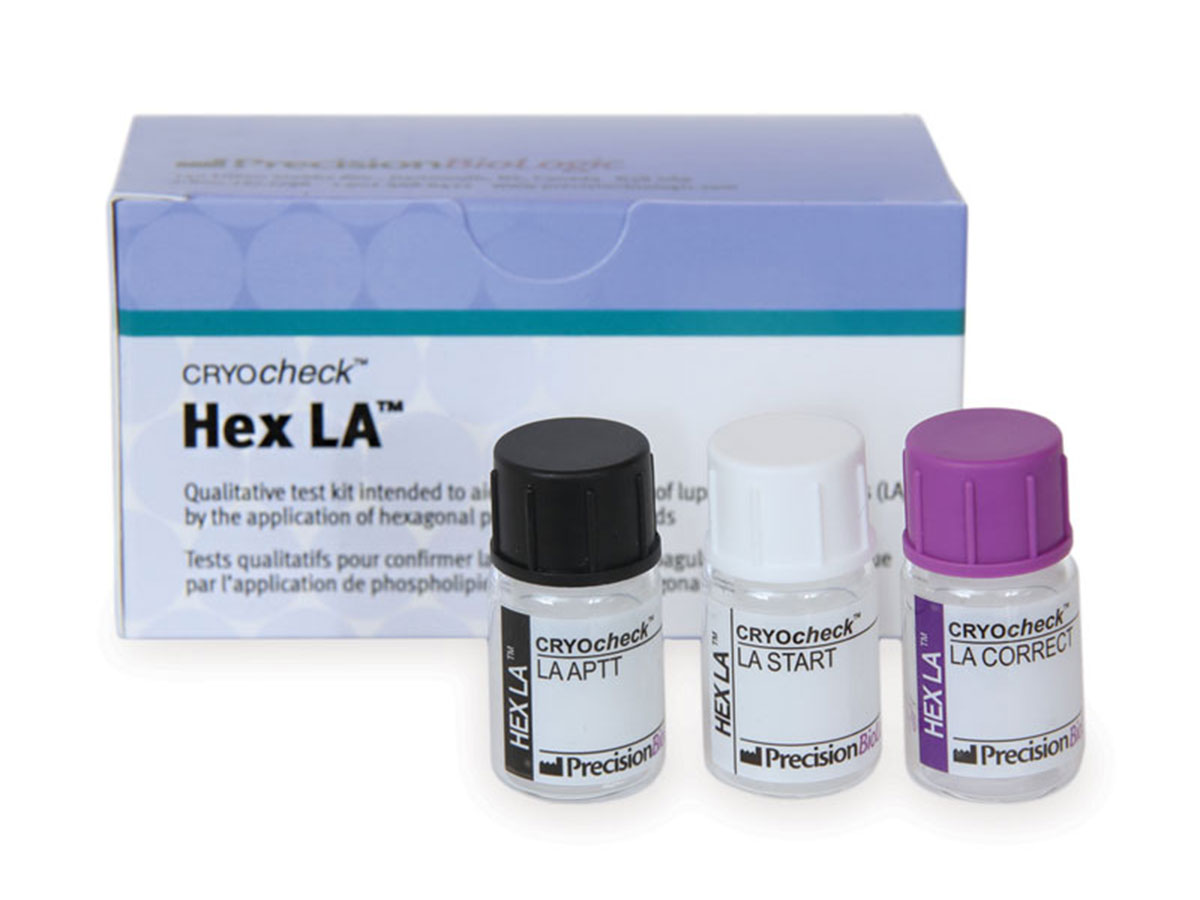
CRYOcheck™ Hex LA™ est un coffret de test qualitatif destiné à confirmer la présence du lupus anticoagulant (LA) en utilisant des phospholipides en phase hexagonale.
DOAC-Stop Liquid™

Une suspension de charbon activé utilisée pour éliminer tous les types de NOAC, y compris le dabigatran, l'apixaban, le rivaroxaban et l'edoxaban, avec un effet minimal sur les variables de la coagulation actuellement connues.
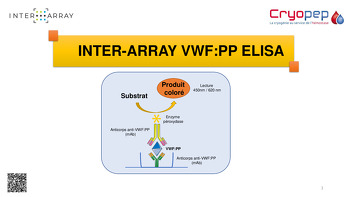
INTER-ARRAY VWF:PP ELISA Kit
Le coffret ELISA VWF:PP est destiné au dosage immunoenzymatique quantitatif du propeptide du Facteur von Willebrand (VWFpp) dans le plasma.
Pefakit® TAFI
Pefakit® TAFI est un test chromogénique basé sur le plasma pour la détermination de l'activité du TAFI.
T-TAS® 01

Système microfluidique sur puce (AR, PL and HD Chip) pour quantifier le processus de formation du thrombus en condition de flux en sang total.
TECHNOZYM® ADAMTS-13 INH Calibrator Set
Plasmas de calibration pour le dosage antigénique de l'ADAMTS-13.
Plasma Humain Déficient congénital en Facteur IX

Donneur adulte présentant une déficience congénitale en Facteur IX. Les plasmas déficients natifs en facteur de la coagulation sont des plasmas frais congelés issus exclusivement de donneurs ayant un déficit congénital sévère en facteur de la coagulation.
Fabrication et distribution de réactifs de diagnostic in vitro et produits de recherche pour l’hémostase et la thrombose.
Spécialisée dans le domaine de l’hémostase, Cryopep offre une nouvelle alternative aux traditionnels réactifs lyophilisés en proposant aux laboratoires de biologie médicale une gamme innovante de réactifs prêts à l’emploi.
La société Cryopep, de par son savoir-faire et son innovation, conçoit et met au point de nouveaux outils diagnostiques pour l’exploration des maladies de l’hémostase, de la thrombose et de l’auto-immunité.